课题名称:自调控进化的黏球菌系统
成员:王建烨、张怿扬、李行之、杨彦萍、葛治言、焦思源
指导单位:四川大学 生命科学学院
课题核心:针对全球抗微生物药物耐药性(AMR)危机及污水管网耐药菌传播问题,本研究利用合成生物学技术改造黄色粘球菌(Myxococcus xanthus),构建兼具“主动捕食+靶向识别+自适应进化+生态安全”特性的“活体抗生素”,实现对下水道中ESKAPE病原体的精准清除,为AMR防控提供创新生物解决方案。
Background
1. 抗微生物药物耐药性(AMR)现状
根据华盛顿大学在《柳叶刀》上发表的分析表示,抗微生物药物耐药性(AMR)的致死率已经达到了令人咋舌的程度。仅在2019年,全球就有约495万例死亡与细菌性AMR相关联,其中127万例死亡直接由AMR引起 。这一数据令人触目惊心,因为它表明:AMR导致的直接死亡人数已经超过了艾滋病(HIV/AIDS)或疟疾这两大传统全球卫生杀手 。
世界卫生组织《Bracing for Superbugs》报告指出,若不立即采取系统有效的遏制措施,到2050年,每年因耐药菌感染导致的死亡人数可能攀升至约1000万,这一数字将超越癌症目前的致死人数,成为人类最大的健康威胁之一。

左图:2019年全球AMR相关死亡数据(《柳叶刀》);右图:2050年AMR致死率预测(WHO《Bracing for Superbugs》)
2. 污水管网:耐药菌的“遗传反应堆”
研究证实,城市污水管网系统,是耐药基因(ARGs)与耐药细菌(ARB)演化及传播的关键枢纽 。污水管网现已成为耐药菌的“遗传反应堆”,主要特征包括:
- 耐药菌在管壁成团粘附
- 三维网状生物膜基质阻挡抗生素和消毒剂的渗透
- 水平基因转移(HGT)致使耐药基因链式扩散
- 休眠状态的持久性细胞(Persister Cells)对依赖代谢活动的传统抗生素具有天然耐受性
传统化学方法无法有效消灭污水管网环境中的耐药菌群,主要问题包括:
- 在流动管网中投放化学消毒剂难以达到有效浓度
- 水相化学消毒剂难以与积聚在管道顶端气相环境的菌群接触
- 生物膜基质的阻挡作用使得化学消毒剂难以渗透
- 高浓度化学消毒剂对管壁产生强烈的腐蚀作用造成更严重的问题
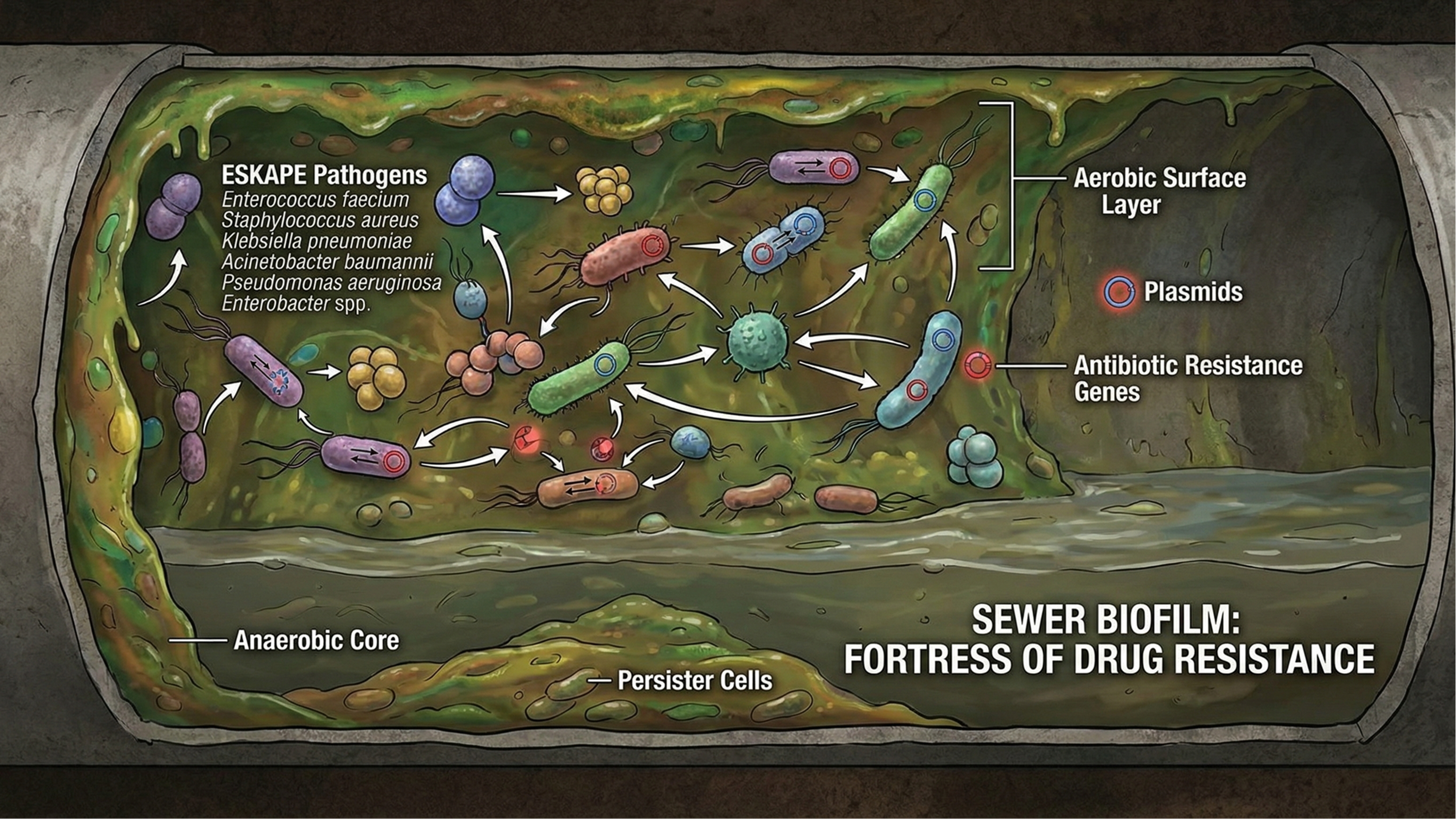
污水管网中耐药菌的粘附、生物膜形成及耐药基因扩散过程示意图
3. 课题提出:“活体抗生素”解决方案
针对上述问题,本课题提出了一种基于合成生物学的创新治理方案:利用基因工程改造的“活体抗生素”——粘细菌 (Myxococcus xanthus),结合纳米抗体表面展示技术完成对下水道中的ESKAPE病原体进行主动搜索、定点捕获和深度清除。该方案融合了 SpyTag-SpyCatcher 表面展示技术、CRISPR 引导的 EvolvR 定向进化系统,双组分系统介导的信号转导,以及逻辑门控自杀系统,旨在构建一种能够自我迭代、具有高度特异性且生态安全的智能捕食者。
4. 理论基础:Myxococcus xanthus的天然优势
Myxococcus xanthus(黄色粘球菌),革兰氏阴性杆菌,在下水管网中原生存在,具备作为“活体抗生素”底盘的天然优势:
- 广谱杀伤能力:采用“群体攻击”方式,分泌多种胞外酶(蛋白酶、脂酶、溶菌酶)和抗生素,裂解并消化细菌、真菌等多种微生物,甚至捕食小型真核生物。
- 主动运动与生物膜穿透能力:拥有IV型菌毛(Type IV Pili, T4P)驱动的“S-运动”(Social motility),能够像犁一样物理性地穿透并破坏致密的EPS基质,直达生物膜深层的病原体。
- 环境适应性:作为下水道土著微生物,能适应缺氧、营养复杂的极端环境,无需额外调控即可定植。
- 安全性:非致病性,对人类及高等生物无危害,降低生态风险。
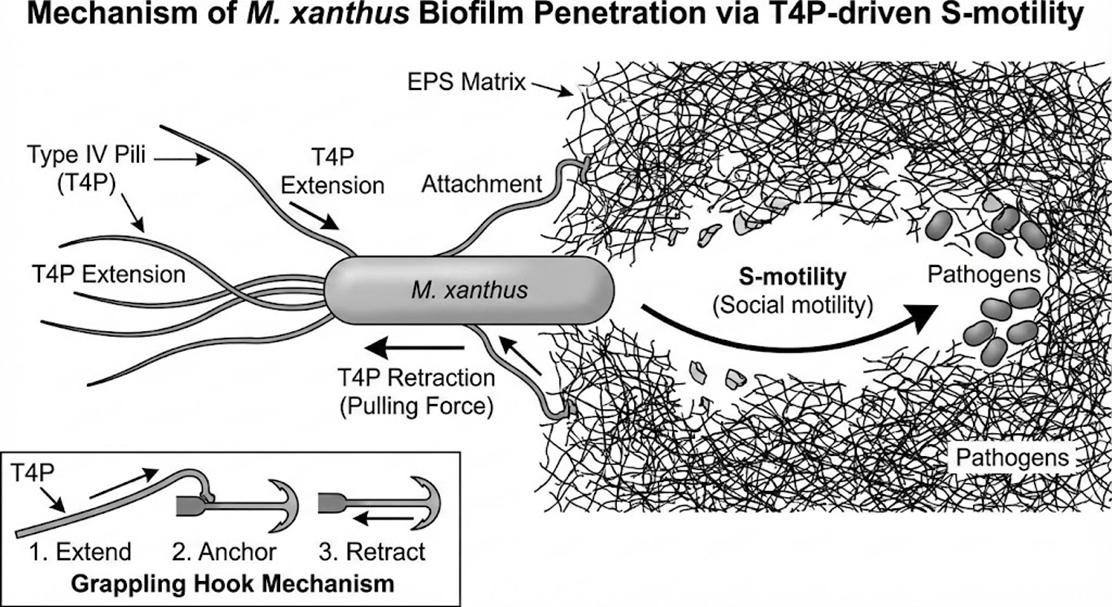
Myxococcus xanthus T4P驱动的S-运动机制:通过“延伸-锚定-收缩”(Grappling Hook Mechanism)穿透生物膜EPS基质
此外,Myxococcus xanthus具备完善的分泌系统(如Type IV、Type VI分泌系统),可高效分泌外源重组蛋白(如纳米抗体、裂解酶),为表面展示技术和效应分子释放提供天然载体,进一步支撑“靶向识别+高效杀伤”功能的实现。
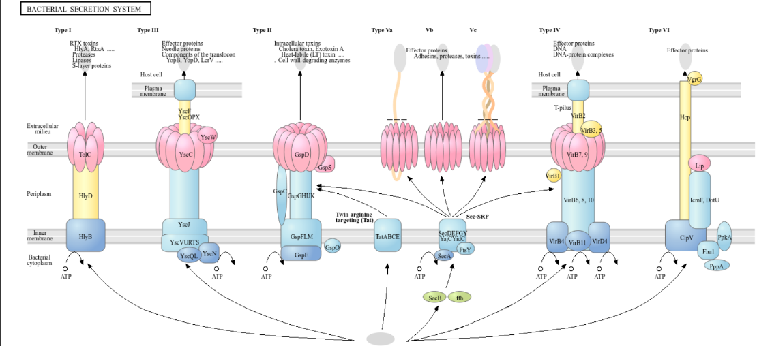
细菌主要分泌系统类型(含Myxococcus xanthus优势分泌系统):支撑外源蛋白分泌与效应分子释放
Design
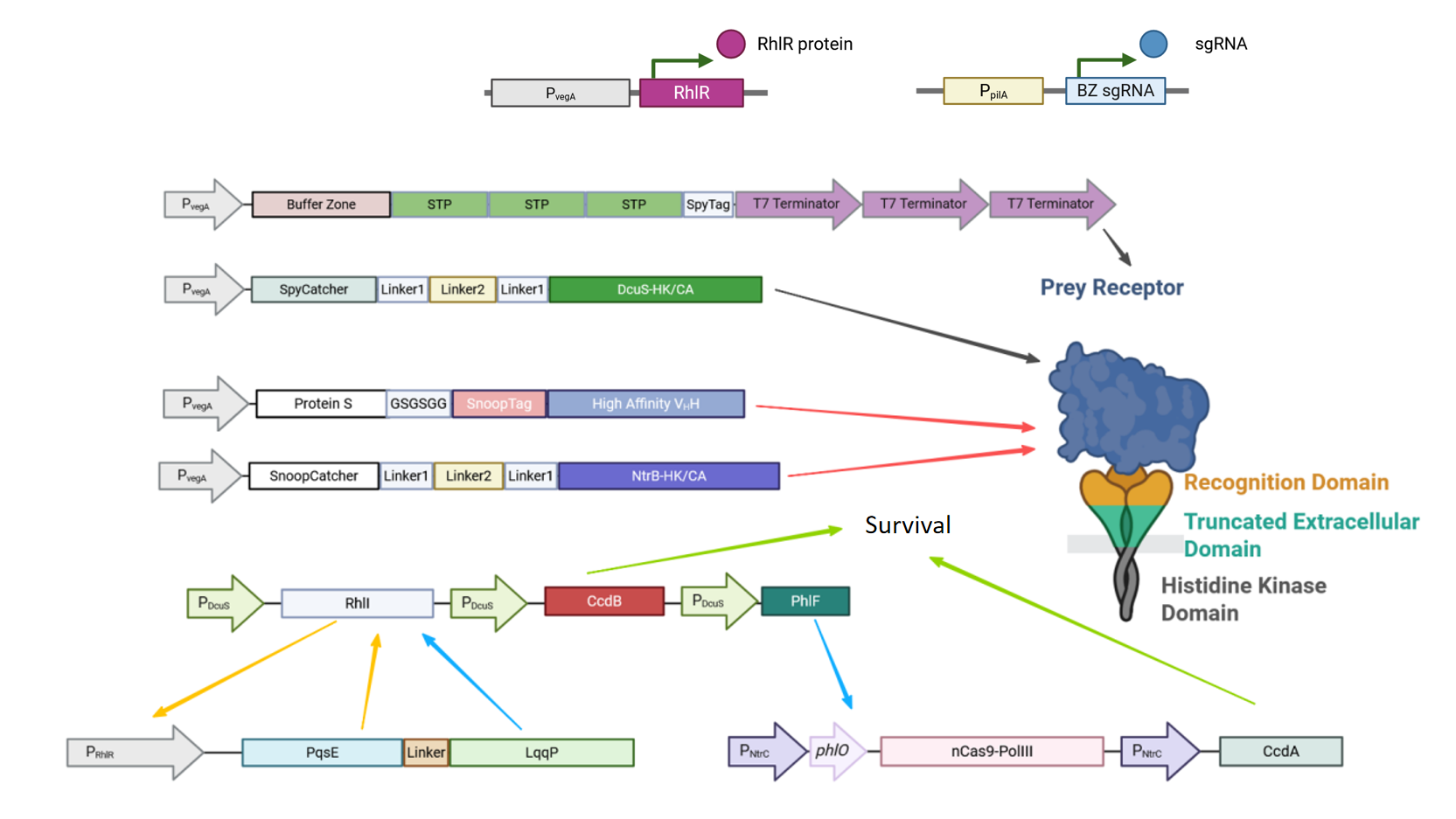
1. Sensing Part(传感模块):靶向识别与信号激活
1.1 表面展示系统:靶向肽与纳米抗体锚定
采用M. xanthus中已被证明的较强启动子PvegA(vegA蛋白的启动子),在尽量降低代谢毒性的前提下减轻代谢负担。融合M. xanthus FibA分泌信号的三联特异性表面肽和抗体尾端分别偶联表达对应的小肽信号SpyTag及SnoopTag,减少经Sec/Tat分泌的影响;同时纳米抗体融合M. xanthus的Protein S蛋白,极大提高分泌效率,亦可以由Protein S介导黏附在其孢子表面,提高其子代的特异性定植率。
Buffer Zone含有大量sgRNA能识别的独一重复序列,到SpyTag为止总长不超过350 bp,设置多个串联的终止子防止终止失效致使翻译形成的mRNA无效延伸。
1.2 双组分系统(TCS I/II):信号转导与逻辑调控
将TCS系统的膜激酶样受体截短后融合异源感受结构域构造定制化的膜传感平台,在两种大肠杆菌来源的TCS系统基础上进行N端胞质侧截短,通过(AP)10-Fn3-(AP)10桥联SpyCatcher和SnoopCatcher两个正交异肽键标记系统,从而共价偶联对应表面模块,其中通过二聚化激活而转导转录启动信号,启动下游组分表达。Sensing Part由于split tag系列系统而实现了相关特异性模块的高度工程化与定制化。
TCS I由E. coli的C4感受通路DcuS/DcuR改造而来,TCS II由E. coli的硝酸盐感受通路NtrB/NtrC改造而来(两组分系统HK/RR)。人工受体在单体形式下不激活,当结合胞外临近靶标后相互靠近,二聚激活,DHp/CA域发挥HK活性。
左图:TCS I(DcuS-HK/CA-SpyCatcher)表达 cassette;右图:TCS II(NtrB-HK/CA-SnoopCatcher)表达 cassette
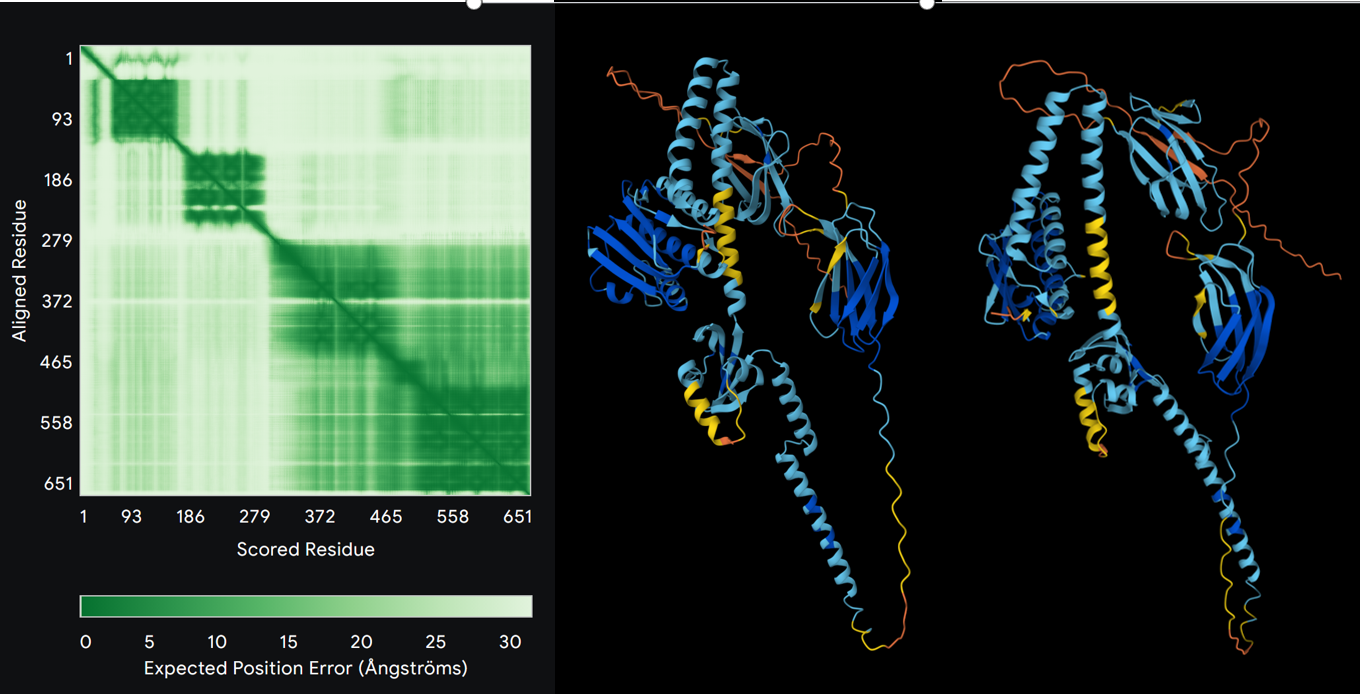
左图:TCS I受体蛋白Alphafold3结构预测(预期Position Error);右图:TCS II受体蛋白Alphafold3结构预测
2. Effector Part(效应模块):杀伤激活与自适应进化
2.1 TCS I下游效应:杀伤激活与进化阻遏
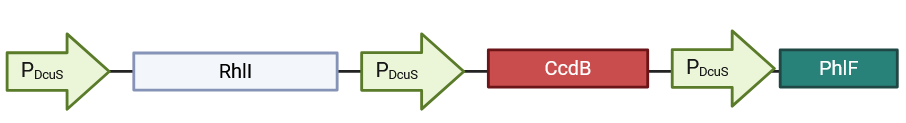
采用DcuS系统的下游特异性启动子PDcus,作为TCS I激活后的特异性响应。DcuS激活后产生三个效应:
- Pseudomonas aeruginosa来源的C4-AHL合成酶RhlI的表达产生C4-AHL(M. xanthus自身能够合成前体Butyryl-ACP),被RhlR感知;
- gyrase阻遏毒力因子CcdB;
- E. coli来源的强阻遏子PhIF通过phlO元件阻遏EvolveR系统工作(即阻遏nCas9-PolIII表达)。
M. xanthus胞内C4-AHL蓄积达到感受阈值,由PrhlR(NM)(iGEM Part:BBa_R0071, 2014 Tokyo_Tech)高分辨特异性启动子启动表达。下游为RhlI稳定蛋白PqsE(同样来自P. aeruginosa,RhlR不稳定,转录活性较弱)经柔性连接子与Lysobacter enzymogenes OH11来源的LuxI-like quencher LqqP融合表达,增强下游信号的同时灭活RhlI,避免过度激活增殖导致生物风险(M. xanthus自身不合成但能监听其他物种的AHL,C4-AHL可以最大限度促进其捕食和杀伤)。
左图:PDcuS启动子驱动的RhlI/PhIF/CcdB表达 cassette;右图:PrhlR驱动的PqsE-LqqP融合表达 cassette
2.2 TCS II下游效应:EvolvR定向进化系统
对TCS II,NtrC下游表达EvolveR关键组分nCas9-PolIII以及抗毒素CcdA。由于M. xanthus存在Rnase D等核酸酶,本身加工大量sRNA调控fruiting body等的发育,组成型表达的sgRNA在无nCas9结合时有极低的脱靶或干扰率,只有与nCas9结合后才能免于降解,发挥功能。同时由于phlO的存在,其活性可在TCS I激活时被阻断。
TCS能够被成功激活意味着靶向肽可以识别目标菌,反之说明目标菌出现变异能够逃逸,需要进行群体进化与筛选;TCS II依赖菌体自身裂解或捕食裂解释放出的抗原,若能被激活说明定植在靶标菌附近,反之则不在,可能出现进化后对非靶向菌群识别的情形。
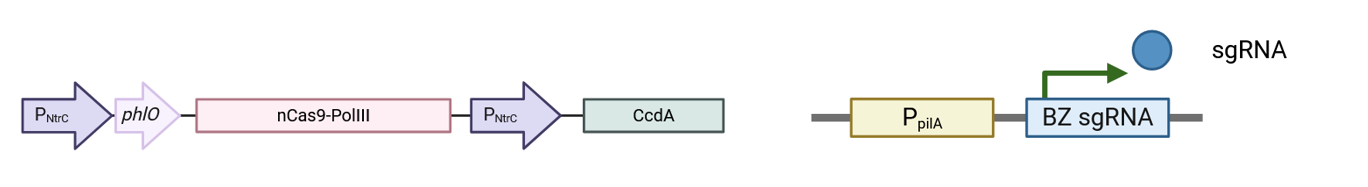
左图:PNtrC启动子驱动的nCas9-PolIII/CcdA表达 cassette;右图:EvolvR工作机制:nCas9定点nick+PolIII低保真合成实现靶向突变
不同TCS激活状态下工程菌的行为逻辑:
| 状态 < | TCS I Activated < | TCS I Deactivated |
|---|---|---|
| TCS II Activated | 目标未逃逸,已经进化成功,不死亡,不进化 | 目标逃逸,不死亡,进化 |
| TCS II Deactivated | 进化失败,错误识别,死亡淘汰 | 进化失败,无功能,死亡淘汰 |
3. Safety Part(安全模块):生态风险控制
采用经典pDawn系统进行菌体自杀,若脱离无光的下水道环境则进行自杀。该系统包含:
- 光感应元件:YF1(蓝光受体)与FixJ(响应调节因子),在蓝光照射下发生相互作用并激活下游启动子;
- 自杀执行元件:PR启动子驱动的Endolysin(溶菌酶),当工程菌逸出下水道进入有光环境时,Endolysin表达并裂解菌体,防止生态扩散;
- 调控元件:cl阻遏蛋白,在无光环境下抑制Endolysin表达,确保工程菌在目标环境中正常存活。
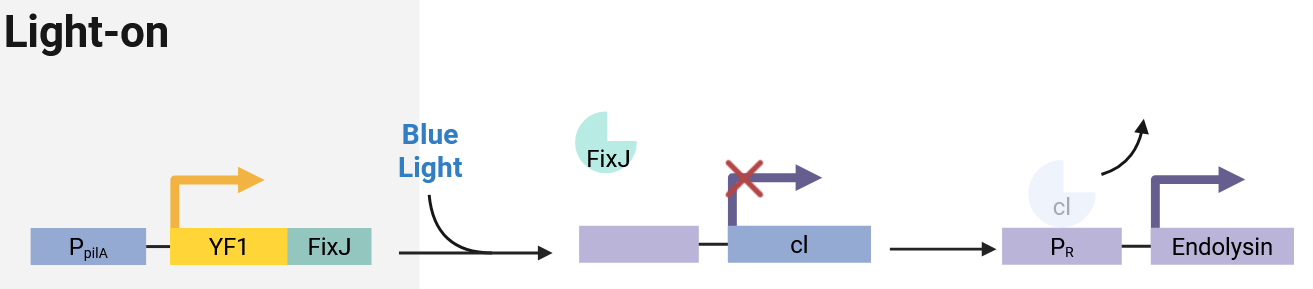
pDawn光控自杀系统工作原理:无光环境(下水道)中存活,有光环境(逸出)中启动自杀
4. 创新点
4.1 底盘微生物的创新性选型与功能融合
摒弃传统异源工程菌底盘,选用黄色粘球菌作为核心载体——其天然具备捕食革兰氏阴性/阳性细菌的能力,搭配类SpyTag-SpyCatcher膜展示系统定向锚定双特异性纳米抗体(SEB靶点、PcrV靶点),实现“靶向识别+主动捕食”双重功能叠加,相较单一抗体靶向或单纯微生物捕食,大幅提升对下水道耐药菌的精准清除效率,解决传统方案靶向性弱、清除不彻底的难题。
4.2 耐药应对与捕食效能的协同适配机制
将CRISPR-Cas9定域突变系统与黄色粘球菌的捕食特性、纳米抗体靶向性深度耦合。粘球菌的捕食行为可加速对耐药菌的接触与识别,定域突变系统同步响应耐药菌突变,动态优化纳米抗体结合位点,使工程菌形成“靶向-捕食-突变适配”的闭环,打破耐药菌逃逸识别的技术瓶颈,同时粘球菌捕食裂解细菌的特性可减少耐药基因水平转移风险,延长抗菌体系有效期。
4.3 生态适配与生物安全的双重升级体系
黄色粘球菌作为环境土著微生物,相较于异源工程菌更易适应下水道缺氧、营养复杂的极端环境,降低外源菌株引入引发的生态失衡风险;搭配基于群体感应与双组分系统的智能自杀机制,既解决抗体突变失效后工程菌与耐药菌共存的隐患,又阻断菌株逸散的安全风险,实现“效能-生态-安全”三者兼顾,填补了土著捕食微生物改造用于耐药菌防控的技术空白。
Model
1. 进化模拟模块:AB菌捕食-进化动态模型
建模原理:结合进化机制与 Lotka-Volterra 菌间捕食关系模型,用离散动力学方程表示环境中的随机正负进化,用捕食-被捕食模型量化黄色粘球菌(A菌,捕食者)与耐药菌(B菌,猎物)的动态作用关系。
核心逻辑:定向进化开关响应耐药突变信号+粘球菌捕食行为强化选择压力,实现对两类菌生长情况的模拟。其中,A菌进化因子随B菌耐药突变率动态调整,捕食效率与A菌靶向识别能力(纳米抗体结合效率)正相关。
关键结果:模拟估计得出在预设条件下的耐药菌生存结果(是否能够彻底杀灭),预估耐药菌的杀灭时间。从模拟曲线可见:A菌随B菌密度变化呈现典型捕食者波动,进化因子在B菌出现耐药趋势时显著升高,最终实现B菌密度降至检测限以下。
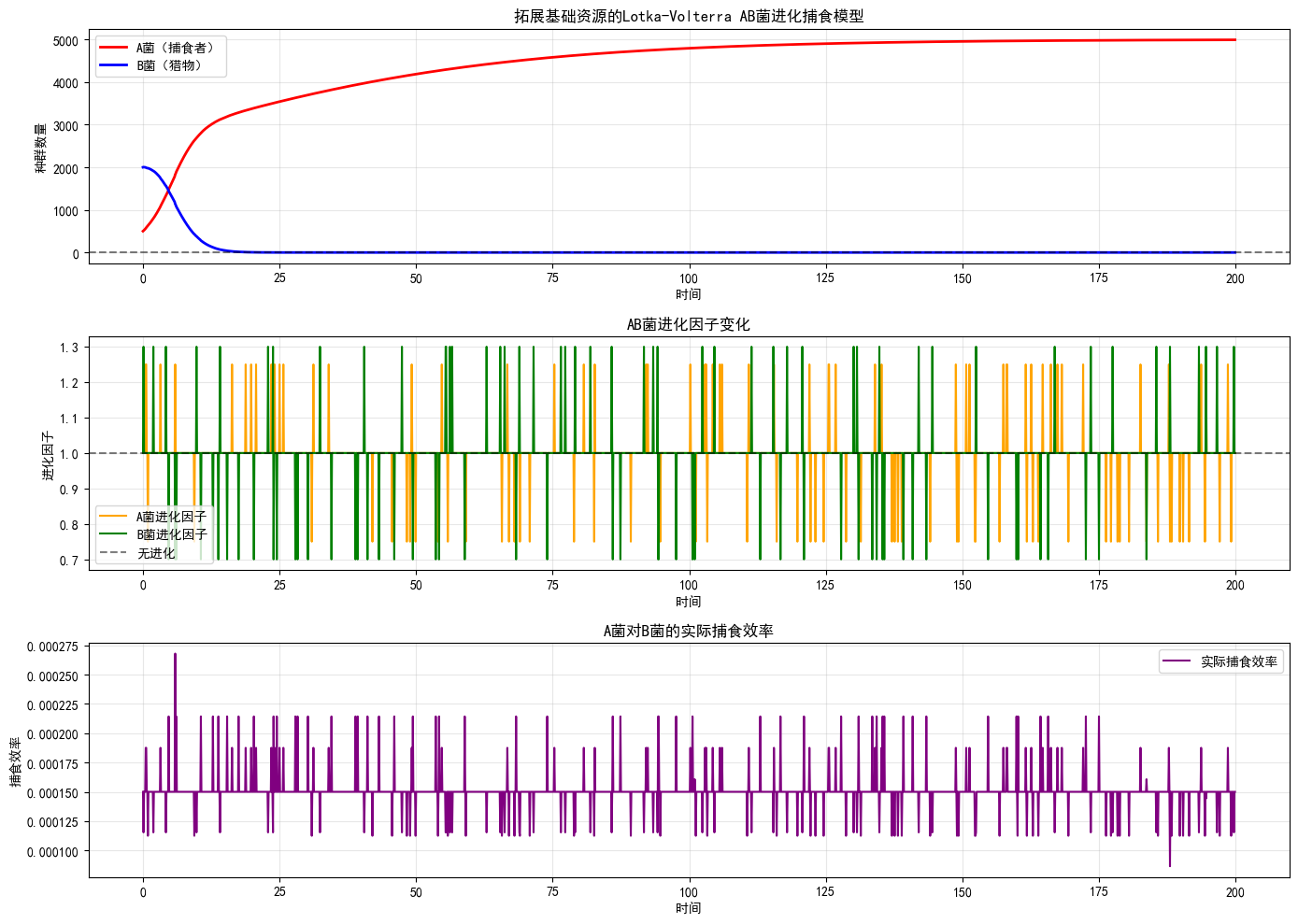
上图:A菌(捕食者)与B菌(猎物)种群密度动态变化;中图:A/B菌进化因子随时间变化;下图:A菌对B菌实际捕食效率变化
2. TCS I/II信号通路模块:信号动态与阈值响应模型
建模原理:整合双组分系统(TCS I/II)与群体感应信号网络,通过常微分方程(ODE)模拟信号分子的浓度动态变化情况,逻辑门控模型量化通路间交叉调控关系。核心方程包括:信号分子合成/降解速率、受体结合动力学、下游效应分子表达调控。
核心逻辑:TCS 通路分路调控杀伤激活/进化启动/自杀触发 + QS信号(C4-AHL)介导阈值响应。TCS I激活后启动杀伤相关基因(RhlI)并阻遏进化(PhIF),TCS II激活后启动EvolvR系统,两者通过信号浓度阈值实现逻辑协同。
关键结果:实现导入的信号网络的动态组分模拟,模拟不同目标菌浓度下的信号通路各组分的动态变化。结果显示:目标菌浓度越高,TCS I激活程度(激活态TCS I浓度)、C4-AHL积累量及负反馈因子(PqsE-LqqP)表达量越高,EvolvR系统(进化阻遏解除)活性越低,符合“高靶标密度下优先杀伤、低靶标密度下启动进化”的设计逻辑。
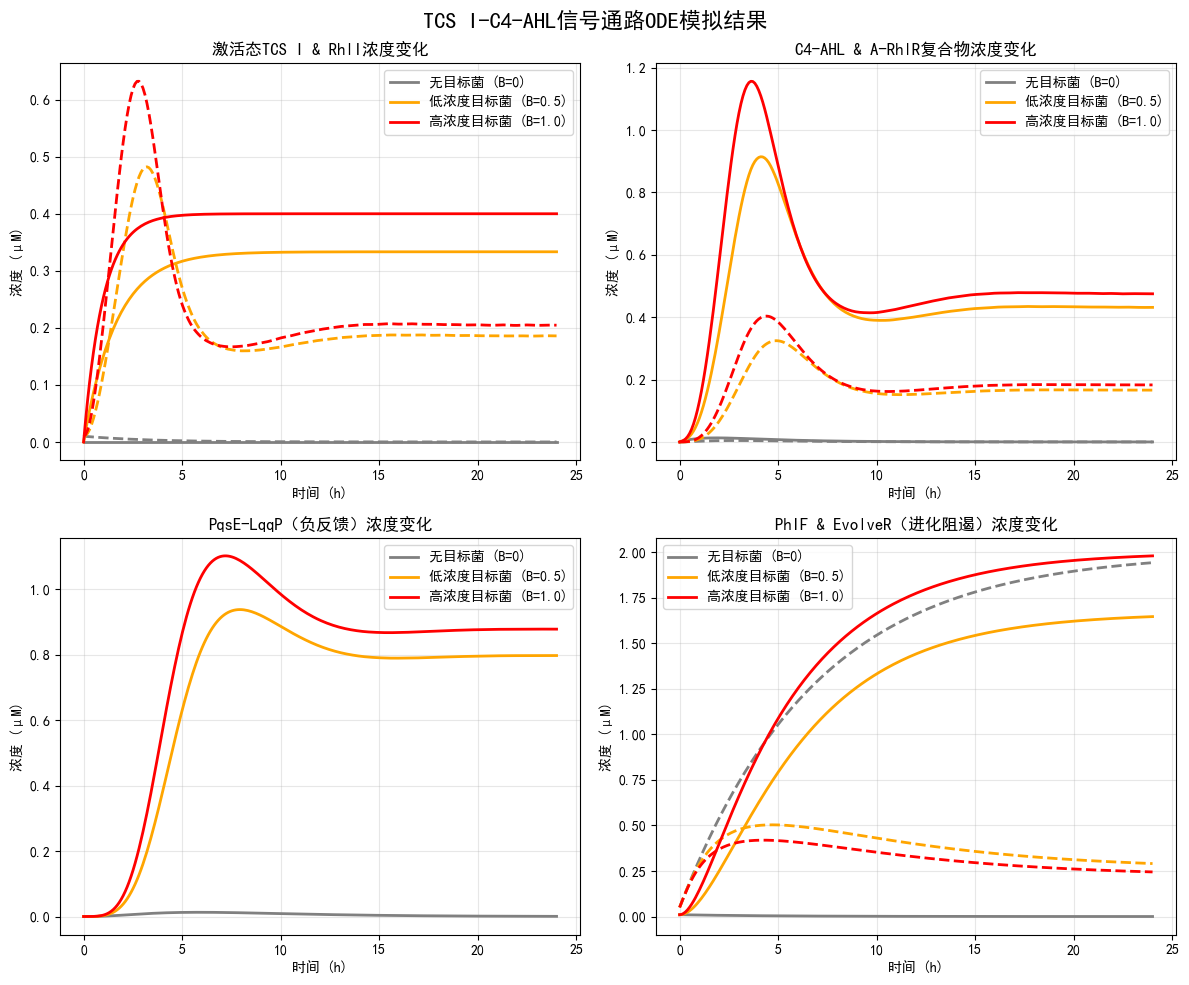
左上:激活态TCS I与RhlI浓度变化;右上:C4-AHL与RhlR复合物浓度变化;左下:PhIF(EvolvR阻遏)浓度变化;右下:PqsE-LqqP(负反馈)浓度变化
不同目标菌浓度下24小时稳态浓度结果:
| 目标菌条件 < | 激活态TCS I(μM) < | C4-AHL(μM) < | PqsE-LqqP(μM) < | EvolvR(μM) |
|---|---|---|---|---|
| 无目标菌(B=0) | 0.0 | 0.0 | 0.0005 | 1.9422 |
| 低浓度目标菌(B=0.5) | 0.3333 | 0.4313 | 0.7971 | 0.2908 |
| 高浓度目标菌(B=1.0) | 0.4 | 0.4749 | 0.8777 | 0.2448 |
Human Practice
1. 预期成果
- 构建一套模块化、可编程的合成细菌防御系统,实现“识别-杀伤-自适应-自调控”的全流程闭环。该系统可根据目标耐药菌类型,通过更换表面靶向模块(如纳米抗体、特异性肽)快速适配不同应用场景,具备良好的通用性。
- 验证 “定域突变” 概念在对抗细菌耐药性演化中的可行性,为合成生物学提供动态进化调控的新范式。通过实验证实EvolvR系统可在复杂环境中(如污水管网)响应耐药菌突变,动态优化靶向分子,打破“耐药-失效”的恶性循环。
- 开发一套结合CRISPR-Cas与易错聚合酶的原位定向进化工具包,可应用于其他需要表面蛋白快速适配的场景(如抗体药物开发、环境污染物降解酶改造),为合成生物学领域提供通用技术支撑。
- 为下水道、医院废水等特定环境下的耐药致病菌防控,提供一种全新的、可持续的活体生物解决方案。通过小试、中试验证工程菌在实际污水中的清除效率,形成可落地的技术方案与工艺参数,助力环境AMR防控产业化。
2. 研究意义
2.1 科学意义
本课题推动合成生物学从“构建功能”向“构建智能、可进化系统”发展。它不仅是一个应用项目,更是一个探讨人工生命系统如何与环境(耐药菌)进行动态博弈的基础研究平台,对理解进化动力学和系统控制论具有重要价值。通过解析工程菌与耐药菌的共进化关系,可为微生物互作、耐药性演化等基础生物学问题提供新的研究视角与实验模型。
2.2 社会与应用意义
为解决日益严峻的细菌耐药性问题提供了原创性思路。若成功,可减少传统抗生素在下水道等环境中的滥用与排放,降低环境AMR选择压力,助力“One Health”(一体化健康)理念的实践——从环境层面切断AMR传播链,保护人类、动物与环境的健康安全。同时,该技术无需复杂设备与高成本化学试剂,适合在发展中国家及基层地区推广,具有广泛的社会适用性。

3. 行业与公众沟通
- 环境与水务行业对接:走访市政污水处理厂,了解现有污水消毒工艺的瓶颈(如消毒剂用量、耐药菌去除率);与水务企业合作开展中试,验证工程菌在实际污水中的应用效果,收集行业需求与改进建议。
- 医疗行业交流:访谈医院感染控制科、检验科,了解医院废水耐药菌特征与防控难点;探讨工程菌在医院废水预处理中的应用可能性,形成“医疗-环境”协同防控方案。
- 公众科普与认知提升:制作“AMR危机与活体抗生素”科普短视频、图文手册,通过社交媒体、社区讲座等渠道传播,向公众解读耐药性危害与生物防控技术原理,消除对“基因工程菌”的认知误区,提升公众对AMR防控的参与意识。
- 政策与标准建议:基于研究成果,向环保部门、卫生部门提出环境AMR防控的技术标准与政策建议(如工程菌使用安全规范、环境AMR监测指标),推动活体生物防控技术的规范化、合法化应用。
